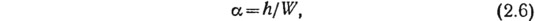Степень гидратации цемента это
Степень гидратации цемента это
Трехкальциевый силикат. Понимание поведения при гидратации индивидуальных составляющих цемента и их смесей — основа для интерпретации сложных реакций, протекающих при гидратации цемента в различных условиях.
Трехкальциевый и двухкальциевый силикаты составляют 75—80 % цемента. В полностью гидратированном цементе или C3S 60—70 % твердой фазы состоит из C-S-H. Он плохо закристаллизован, содержит частицы коллоидных размеров, показывает два размытых небольших пика на рентгенограмме. Степень гидратации C3S может быть измерена определением C3S или Са(ОН)2 рентгеновским методом, неиспаряемой влаги прокаливанием или Са(ОН)2 термическим или химическим методами. Каждый из этих методов имеет свои ограничения. Количество Са(ОН)2, определенное рентгеновским и химическим методами, неодинаково. К примеру, в было найдено 22 % Са(ОН)2 в камне из портландцемента рентгеновским методом, а химическим методом (экстракция) Са(ОН)2 определяется на 3—4 % больше. Эту разницу можно отнести за счет аморфного Са(ОН)2. С другой стороны, сообщается, что метод экстракции дает Са(ОН)2 на 30—90 % больше, чем рентгеновский метод.
Термогравиметрический метод анализа приводит к тем же величинам, что и рентгеновский. В последнее время дифференциально-термический анализ был применен для определения Са(ОН)2 в гидратированном C3S.
Хотя общая тенденция аналогична, результирующая величина выше при применении химического метода. Это может быть объяснено воздействием на фазу C-S-H растворителей, используемых при химической экстракции. Отсюда ясно, что определение состава C-S-H, которое основано на определении C3S и Са(ОН)2, имеет ограничения. Состав фазы C-S-H может быть изменен с помощью добавок. Прямой метод определения отношения C/S основан на таких методах, как электронная микроскопия или электронная спектроскопия. Несмотря на то что имеется несколько различающихся величин, в основном отношение C/S после небольшой продолжительности гидратации находится в пределах 1,4—1,6. Имеются проблемы, связанные с определением воды, химически связанной в C-S-H. Встречаются затруднения при дифференциации ее от поровой воды.
Стехиометрию C-S-H определяют в предположении, что в пробе либо вовсе не остается, либо остается очень мало адсорбированной влаги в условиях d-сушки (давление паров воды при температуре сублимации твердого С02, т. е. при —78° С). В исследованиях было показано, что высшие гидраты могут существовать и при влажности, близкой к d-сухим условиям. Считается, что высушивание до относительной влажности (ОВ) 11 % является надежным способом для изучения стехиометрии гидратов силиката кальция. В этих условиях может быть с достаточной надежностью оценена адсорбированная вода. Не следует полагать, что высшие гидраты не существуют при ОВ выше 11 %. C3S, гидратированный в колбе до C-S-H и доведенный до равновесия при 11 % ОВ (начиная со 100% ОВ), имеет состав 3,28СаО-2Si02-3,92H20.
Двухкальциевый силикат. При гидратации C2S, как и C3S, имеются неопределенности, связанные с нахождением стехиометрического состава фазы C-S-H; гидратация двух-кальциевого силиката может быть представлена следующим уравнением:
2(2CaO-Si02) + 5H20 — 3CaO — 2Si02 — 4Н20 + Са(ОН)2.
Количество Са(ОН)2, образующегося в результате такой реакции, меньше, чем при гидратации C3S. Фаза двухкальциевого силиката гидратируется намного медленнее, чем фаза трехкальциевого силиката.
Абсолютные значения скоростей неодинаковы в разных пробах; это индивидуальная характеристика, однако в среднем скорость реакции у C3S намного выше.
Повышенную реакционную способность C3S объясняют следующими причинами: в C3S координационное число Са2+ выше 6; координация Са2+ нерегулярна; в кристаллической решетке C3S имеются пустоты; наблюдаются различия, встречающиеся в позициях на фермиуровнях. Проведены некоторые предварительные работы для определения относительной реакционной способности Са2+ в CaO, Ca(OH)2, C3S и при смешивании каждого из них с известными количествами AgN03. Найдено, что при последующем нагревании реакция AgN03 с СаО, Са(ОН)2 и гидратированным C3S стехиометрична относительно Са2+. Только 27 % Са2+, присутствующего в C3S, и 6 % Са + из C2S реагируют с AgN03. Возможно, что активности C3S и C2S являются таковыми вследствие дефектов в их структуре. Имеются данные о том, что при гидратации C3S, полученного присоединением одной молекулы меченого Са к C2S, начальные продукты реакции содержат в основном меченый ион Са2+.
Трехкальциевый алюминат. Несмотря на то что среднее содержание С3А в портландцементе составляет 4—11 %, его влияние весьма заметно на начальной стадии гидратации. Он обычно ответствен за феномен «ложного» схватывания; образование различных гидратов алюминатов кальция, карбо- и сульфоалюминатов также имеет место при реакциях С3А. Большие количества С3А в портландцементе могут повлиять на долговечность бетона. К примеру, цемент для бетона, который будет выдерживаться в сульфатных растворах, не может содержать более 5 % С3А.
Трехкальциевый алюминат реагирует с водой, образуя С2АН8 и C4AHi3 (гексагональные фазы). Эти продукты термодинамически нестабильны, поэтому без стабилизации или добавок они переходят в фазу С3АН6 (кубическая фаза).
В насыщенном растворе Са(ОН)2 С2АН8 реагирует с Са(ОН)2, образуя в зависимости от условий С4АН)3 или С3АН6. Кубическая форма (С3АН6) может образоваться и в результате непосредственной гидратации С3А при 80 °С или более высокой температуре.
При нормальных условиях гидратации камень из С3А дает меньшую прочность, чем из силикатных фаз, вследствие образования кубической фазы С3АН6.
При определенных условиях гидратации, т. е. при низких водотвердых отношениях (В/Т) и высокой температуре, прямое образование С3АН6 (приводящее к возникновению непосредственных связей между частицами) может существенно повысить прочность. В портландцементе гидратация фазы С3А контролируется добавлением гипса. Таким образом снимается «ложное» схватывание.
Фаза С3А реагирует с гипсом в течение нескольких минут, образуя эттрингит.
После того как весь гипс перейдет в эттрингит, избыток С3А вступает в реакцию с этрингитом, образуя низкосульфатную форму гидросульфо-алюмината кальция.
Гипс — более эффективный замедлитель гидратации С3А, чем известь; вместе они еще более эффективны, чем каждый в отдельности.
Ферритная фаза, составляющая в среднем 8—13 % состава портландцемента, имеет различный состав. Среди цементных минералов ее гидратационные и физико-механичеекие характеристики привлекают значительно меньшее внимание. Это частично может быть объяснено тем, что ферритная фаза и С3А ведут себя сходным образом. Однако очевидно, что имеются и значительные различия между ними.
Известно, что фаза C4AF дает в целом те же продукты гидратации, что и С3А, но при более медленном протекании реакции. При реакциях C4AF образуются аморфные продукты. Термодинамически стабильная фаза С3(А,F)H6 — это продукт превращения гексагонального гидрата. Иногда образование этого гидрата вызывает ложное схватывание цемента.
Гидратация C4AF при низком В/Т и высокой температуре может увеличить степень прямого образования кубической фазы. Результаты измерений микротвердости показывают, что при В/Т = 0,13 пробы, гидратированные при 23 и 80 °С, имеют микротвердость до 874 и 1770 МПа соответственно. Большая прочность при более высокой температуре может быть объяснена прямым образованием из C4AF кубического С3АН6. Это приводит к их более тесному соединению с ростом механической прочности.
В цементе в присутствии гипса C4AF реагирует значительно медленнее, чем С3А. Другими словами, гипс более эффективно замедляет гидратацию C4AF, чем С3А.
Скорость гидратации зависит от состава ферритной фазы; с ростом содержания железа снижается скорость гидратации.
При низком В/Т и высокой температуре низкосульфатная форма гидросульфоалюмината кальция может образоваться непосредственно.
Особенности гидратации цементов с добавками ПАВ. Микроструктура цементного камня
Особенности химических процессов взаимодействия с водой клинкерных минералов и цементов с добавками ПФМ изучали по кинетике изменения состава жидкой фазы и степени гидратации.
Исследования состава жидкой фазы гидратируемых цементов с добавкой С-3 впервые выполнены Т. Е. Тюриной на цементно-водных суспензиях состава 1:8 [59]. С-3 вводили с водой затворения (1% массы цемента). Как известно [44], данные, полученные па суспензиях, не всегда можно-перенести на цементные пасты, поэтому целесообразно изучить состав жидкой фазы в области реальных В/Ц.
Нами использовано цементное тесто с В/Ц=0,5. Жидкую фазу отделяли от твердой путем фильтрации под давлением [44]. Цементное тесто помещали над водой в специальный термостат, обеспечивающий поддержание температуры (20±0,5)°С. Из термостата через 10; 30 мин; 1, 2, 3, 4, 8 ч отбирали по 500. 700 г теста, которое помещали в пресс-форму и отжимали жидкую фазу. В составе жидкой фазы определяли содержание ионов Са 2+ , а также Al2O3. Содержание Са 2+ устанавливали комплексометрическим методом с индикатором кислотным хром-темносиним. Содержание Al2O3 находили люминесцентным методом. Результаты определения кинетики изменения состава жидкой фазы при введении различных добавок на среднеалюминатном портландцементе представлены на рис. 9, 10.
Из рис. 9, 10 следует, что введение С-3 способствует снижению содержания Са 2+ и увеличению в жидкой фазе Al2O3. В [38, 59] показано, что из минералов цементного клинкера наибольшей адсорбционной способностью по отношению к С-3 обладает С3А, наименьшей β-C2S. Увеличение содержания Al2O3 в жидкой фазе при введении С-3 можно объяснить пониженным содержанием ионов кальция, которые препятствуют растворению С3А.
Введение наряду с С-3 замедлителей схватывания IV группы существенно снижает содержание в жидкой фазе не только ионов Са 2+ , но и оксида алюминия в период, соответствующий участку формирования структуры на кривых пластической прочности (рис. 10, 11). Однако в начале последующего периода содержание Al2O3 и Са 2+ резко возрастает, при этом опережающий рост содержания характерен для Al2O3.
Механизм стабилизации процессов гидратации цементного теста различен в зависимости от характера воздействия компонентов, входящих в ПФМ. Адсорбционный механизм влияния СП доказан в [38, 59]. При этом одним из ведущих физико-химических процессов в механизме действия СП является хемосорбция, что приводит к большему проявлению добавки в смесях с повышенным расходом цемента. Вместе с тем повышенной проницаемостью адсорбционных слоев, создаваемых СП на клинкерных минералах и гидратах, можно объяснить сравнительно небольшой стабилизирующий эффект, вызываемый СП. В [38] высказано предположение, что адсорбционная пленка, образуемая СП, с сетчатым строением, достаточно проницаемым для молекул воды, не создает препятствий для гидратации цемента и образования прочной структуры цементного камня.
Совмещение СП с другими ПАВ как гидрофилизирующего, так и гидрофобизирующего типа и, в частности, с СДБ и КО СЖК, должно увеличивать толщину и снижать степень проницаемости адсорбционных пленок. Наличие гидроксильных функциональных групп предопределяет адсорбцию молекул лигносульфонатов в значительной мере на гидратных новообразованиях, что замедляет структурообразование [16, 38, 41].
Замедляющее действие растворимых фосфатов большинство исследователей [45, 52] объясняют образованием нерастворимых в воде фосфатов на поверхности зерен цемента.
Влияние сахаросодержащих веществ на процессы начальной гидратации цементов — комплексное [45, 49]. С одной стороны, они, будучи сильными ионогенными гидрофилизующими ПАВ, адсорбируются на зернах цемента, экранируют кристаллизационные контакты и тормозят гидратацию. С другой стороны, сахара взаимодействуют с гидроксидом кальция, получающимся преимущественно при гидролизе алита, и образуют кальциевые сахараты. Это снижает степень перенасыщения раствора Са(ОН)2 в начальный период гидратации цемента, что дополнительно замедляет образование коагуляционной и кристаллизационной структур цементного камня. Экранирующее влияние сахаров на гидратацию и твердение цементов резке усиливается с повышением их дозировки. Последнее отрицательно сказывается на прочности цементного камня. Для практического применения в качестве замедляющих агентов, очевидно, целесообразно вводить в цемент сахара в виде сахаратов кальция. При этом сохраняется адсорбционный характер действия замедлителя и устраняется его химическая активность, которая резко снижает степень перенасыщения раствора цементного теста гидроксидом кальция и соответственно уменьшает прочность цементного камня. Поэтому имеет смысл предварительно обрабатывать, например, молочную сыворотку известковым молоком. Таким образом нами получен замедлитель ИСС, позволяющий существенно тормозить схватывание цемента практически без снижения прочности цементного камня в возрасте 28 сут (рис. 11).
Анализ кинетики изменения химического состава жидкой фазы гидратируемых цементов с добавками ПФМ показывает, что после определенного периода стабилизации существенно ускоряется гидратация цементов, что можно объяснить увеличением удельной поверхности реагирующих с водой цементных частиц за счет дефлокуляции.
Исследования кинетики изменения состава жидкой фазы гидратируемых цементов дополнены определением скорости гидратации клинкерных минералов (рис. 11, 12). Скорость гидратации находили как изменение степени гидратации в единицу времени. Степень гидратации определяли по содержанию гидратной воды, используя формулу
где h — количество воды, не испаряющейся при 105°С и присоединенной к 1 г исходного цемента к тому или иному сроку твердения; W — количество не испаряющейся воды, присоединенной к 1 г цемента при его полной гидратации в условиях заданной температуры.
Степень гидратации С3А и C3S изучали в тесте при В/Ц=0,5 и фиксировали при обработке образцов через определенные промежутки времени этиловым спиртом. Из рис. 11, 12 следует, что без введения каких-либо добавок и при добавке С-3 скорость гидратации С3А через 1 ч после затворения водой более чем в три раза превышала скорость гидратации C3S. В последующий период (от 1 до 6 ч) скорость гидратации С3А и C3S изменяется значительно медленнее: от 30 до 35% для С3А и от 7 до 12% для C3S. Добавление к одной части по массе С3А 3,5% гипса (в пересчете на SO3) и одной части Са(ОН)2, т. е. примерное моделирование условий его гидратации в цементе, снижает скорость гидратации почти в два раза. Все добавки ПФМ с замедлителями схватывания IV группы резко понижают скорость гидратации С3А, в том числе при введении гипса. На скорость гидратации C3S, как и следовало ожидать, наибольшее влияние оказывают ПФМ, включающие сахаросодержащие добавки (КП и МС). Перевод сахаров в кальциевые сахараты (добавка ИСС) значительно ослабляет это влияние.
С учетом значительного воздействия на механические свойства микроструктуры и особенностей фазового состава цементного камня выполнены комплексные исследования с применением рентгсноструктуриого и электронно-микроскопического методов. На рис. 13—15 показана микроструктура цементного камня без добавок и с различными добавками. Микроструктура без добавок имеет большое количество мелкозернистых гидросиликатов кальция. Можно предположить, что сульфогруппы, соединенные с карбоциклическими олигомерами нафталин-формальдегидных смол, входящих в состав исследованных добавок ПФМ, образуют комплексы с СаО и водой, которые модифицируют Са(ОН)2. О возможности образования таких комплексов между сульфатами лигнина и Са(ОН)2 утверждается в ряде исследований. Наиболее вероятно образование комплексов между Са(ОН)2 и сульфированными полимерами в присутствии ионов щелочесульфонатной группы (с одновалентным катионом) плотного строения, а также крупноблочных кристаллов гидроалюминатов и гидроксида кальция. Структура микропрепаратов цементного камня, твердевшего в присутствии добавки СДБ, оказалась весьма сходной со структурой цементного камня без добавок, однако фазы гидроалюмината и гидросульфоалюмината кальция просматривались в виде кристаллов, завуалированных тончайшей пленкой адсорбированных добавок. Микроструктура цементного камня, твердевшего в присутствии добавок ПФМ (рис. 14, 15), отличалась от микроструктуры других препаратов. Цементный камень, модифицированный добавками ПФМ, характеризуется более высокой плотностью и дисперсностью зерен гидратных образований; крупные блоки из кристаллов Са(ОН)2 не наблюдаются. Такая структура цементного камня,(коллоидально-метамиктная), как правило, способствует повышению прочности материалов. Современные теории разрушения твердых тел основаны на представлениях о движении дефектов кристаллов вещества (дислокаций) и объединении их в ручьи (трещины). В случае мелкозернистой структуры камня распространение дислокаций затруднено вследствие наличия большого количества препятствий на пути их движения в виде границ раздела микрозерен, поэтому дефекты кристаллов локализуются в микрообъемах и не получают распространения.
При сравнении рентгенограмм препаратов цементного камня в возрасте 28 сут (рис. 16) различия в степени гидратации цемента с добавками и без них не установлены. Интенсивность линий Са(ОН)2 на рентгеновских дифрактограммах (линии 4,90; 2,62; 1,922 Å) в препаратах с добавками ПФМ в несколько раз ниже, чем интенсивность линий в препаратах с СДБ и без добавок. Это может быть обусловлено наличием в препаратах с добавками ПФМ высокодисперсного (аморфовидного) гидроксида кальция.
Гидратация цемента при низких положительных и отрицательных температурах
Говорить о гидратации цемента при отрицательных температурах, казалось бы, не имеет смысла, поскольку вода замерзает при 0°С. Однако частицы клинкера имеют различного рода микротрещины, проникая в которые, а также адсорбируясь на их поверхности, часть воды изменяет свои физические свойства. Такая вода замерзает при отрицательных температурах, а находясь в жидком состоянии, может реагировать с минералами цемента. Вследствие этого, постепенно замедляясь, процесс гидратации С3S; С3А и С4AF наблюдается при температурах до -15°С, a до -10°C.
Нет оснований считать, что продукты, образующиеся при гидратации силикатных минералов при низких положительных и отрицательных температурах, по своему составу заметно отличаются от возникающих в нормальных условиях. Однако влияние температуры заметно проявляется на размере кристаллов. С понижением температуры размер кристаллов гидросиликата кальция уменьшается, a Ca(OH)2 увеличивается. При уменьшении кристаллов CSH(П) увеличивается удельная поверхность гидросиликата.
Так как полного разделения адсорбированной и химически связанной воды, входящей в структуру гидросиликата, достичь невозможно (часть адсорбированной воды удерживается более сильными связями, чем слабо связанная структурная вода), то высокая дисперсность образующегося при низких температурах CSH(II) ощутимо сказывается на количестве связываемой воды, определяемой химическим анализом.
Из данных табл. 5, например, видно, что количество адсорбционно и химически связанной воды при 5 С через 7 суток гидратации в = C2S было почти в 2 раза больше, чем при 20 С за этот же период, хотя степень гидратации была явно больше при 20°С, о чем можно судить по рис. 11. Подобное увеличение количества связываемой воды с понижением температуры отмечалось и при гидратации цементов.
Данные табл. 5 наглядно показывают, что количеством связанной воды нельзя оценивать степень гидратации, если образующиеся гидросиликаты кальция имеют различную степень кристалличности. Несомненно, что связывание большого количества воды при низких положительных температурах обусловлено не только дисперсностью гидросиликата, с увеличением которой адсорбируется больше воды, но и изменением свойств воды с понижением температуры.
При температурах среды ниже 20°С алюминийсодержащие минералы гидратируются в тесте до гексагонального гидроалюмината кальция (С4A*aq), гелеобразных гидроокисей алюминия (в случае С А) и железа (в случае C4AF) и кубического гидроалюмината кальция. Содержание C3AH6 уменьшается с понижением температуры твердения минералов, особенно C4AF. В насыщенном растворе гидроокиси кальция при 0°С гидратация С4AF идет до образования гексагональных кристаллов, представляющих собой твердый раствор между С4АН13 и C4FH13 с соотношением Аl2О3 : Fе2O3 = 1.
Образованнее C3AH6 при пониженных температурах считается маловероятным. Однако это наблюдали многие исследователи. Объясняется оно тем, что в процессе взаимодействия указанных минералов с водой вследствие экзотермичности реакций происходят локальные перегревы смеси, приводящие к разогреванию.
Продукты гидратации силикатных и алюминатных минералов при соприкосновении с углекислотой воздуха карбонизируются, и особенно интенсивно при положительных близких к 0°C температурах вследствие повышения растворимости углекислоты воздуха. При отрицательных температурах из-за замерзания воды процесс карбонизации прекращается.
Можно сделать вывод о том, что процессы гидратации портландцемента не прекращаются полностью при температурах, близких к -15°С. Ho это ни в коей мере не может характеризовать его твердение. Хотя гидратация цемента с понижением температуры за 0°С частично и протекает за счет сохранения некоторого количества воды в жидкой фазе, однако при переходе свободной воды из жидкого состояния в твердое, как правило, происходят объемные деформации, связанные с расширением образующегося льда в цементном камне (бетоне). Возникающие остаточные (необратимые) деформации снижают прочность. Совершенно иная картина наблюдается при твердении в условиях пониженных положительных температур, когда начальные процессы лишь замедляются.
Степень гидратации цемента это




Теплота гидратации цемента
Как и множество химических реакций, реакция гидратации клинкерных минералов имеет экзотермический характер, при этом цемент выделяет до 120 кал/г. Так как теплопроводность бетона сравнительно низка, то внутри массивных бетонных конструкций гидратация приводит к значительному подъему температуры. В то же время наружная часть бетонного массива теряет некоторое количество тепла, так что устанавливается резкий градиент температуры, что при последующем охлаждении внутренней части может привести к образованию трещин.
С другой стороны, тепловыделение при гидратации цемента может препятствовать замерзанию воды в капиллярах свежеуложенного бетона в холодную погоду, поэтому высокое тепловыделение в данном случае является положительным фактором. Ясно, что желательно знать величину тепловыделения различных цементов, чтобы выбрать наиболее подходящий вид цемента для каждого конкретного случая.
Тепловыделением называют количество тепла в калориях на грамм негидратированного цемента, выделяющееся при его полной гидратации при определенной температуре. Наиболее распространенный способ определения тепловыделения заключается в измерении теплоты растворения негидратированного и гидратированного цемента в смеси азотной и фтористоводородной кислот: разница между этими двумя величинами представляет тепловыделение гидратации. Этот метод описан в BS 1370:1947 и аналогичен методу стандарта ASTM С 186—55. Несмотря на то что особых трудностей эти испытания не представляют, необходимо предотвратить карбонизацию негидратированного цемента, так как поглощение 1% СОг приводит к явному снижению тепловыделения на 5,8 кал/г от общего тепловыделения 60—100 кал/г.
Строго говоря, суммарное тепловыделение складывается из тепловыделения химической реакции и тепловыделения в результате сорбции воды поверхностью геля, образуемого в процессе гидратации. Теплота сорбции составляет четвертую часть общего тепловыделения.
Для практических целей необходимо знать не общее тепловыделение, а скорость тепловыделения, которую можно легко измерить с помощью адиабатического калориметра.
езультаты исследований Богга показали, что обычные портландцементы выделяют около половины общего количества теплоты за 1—3 суток, около 3/4— за 7 суток и 83—91% за 6 месяцев. Тепловыделение зависит от химического состава цемента и представляет собой сумму теплот гидратации всех составляющих цемента. Из этого следует, что если известен состав цемента, его тепловыделение может быть определено с высокой степенью точности.
Ниже приведены типичные значения теплоты гидратации чистых клинкерных минералов. Следует отметить, что между тепловыделением и вяжущими свойствами каждого клинкерного минерала зависимости нет.
Вудс, Стейнор и Старк провели испытания ряда заводских цементов, и, используя метод наименьших квадратов, рассчитали участие тепловыделения каждого отдельного клинкерного минерала. Они получили уравнение следующего типа: тепловыделение 1 г цемента равно 136(C3S) + +62 (C2S) +200 (С3А) +30 (C4AF).
Так как в раннем возрасте гидратация отдельных составляющих протекает с различной скоростью, то скорость тепловыделения, так же как и общее количество тепла, зависит от состава цемента. Из этого следует, что снижением процентного содержания наиболее быстро гидрати-рующихся компонентов (С3А и C3S) скорость тепловыделения бетона в раннем возрасте может быть снижена. Тонкость помола цемента также влияет на скорость тепловыделения при гидратации: увеличение тонкости помола ускоряет реакции гидратации и выделение тепла, однако общее количество выделенного тепла не зависит от тонкости помола цемента.
Влияние С3А и C3S на тепловыделение можно видеть на рис. 1.9 и 1.10. Для многих областей применения бетонов умеренное тепловыделение является положительным фактором и производство соответствующих цементов было организовано. Один из таких цементов — портландцемент с умеренной экзотермией — подробно рассматривается в следующей главе.
Расход цемента в смеси также будет влиять на общее количество выделяющегося тепла — это может быть использовано для регулирования тепловыделения.
Влияние других основных клинкерных минералов на рост прочности цемента недостаточно полно изучено. СзА способствует росту прочности цементного камня в возрасте 1—3 суток, но оказывает противоположное влияние в позднем возрасте, особенно в цементах с высоким содержанием С3А или (C3A+C4AF).
Влияние C4AF на рост прочности цемента также имеет спорный характер, хотя это влияние и является незначительным. Вероятно, коллоидное гидратированное соединение CaO-Fe2O3 осаждается на цементных зернах, что замедляет процесс гидратации других клинкерных минералов.
Зная влияние каждого клинкерного минерала на прочность цемента, можно предсказать прочность цемента на основе его минералогического состава.
Практически была изучена только роль силикатов. Влияние содержания C3S на прочность можно видеть из рис. 1.13, на котором приводится прочность стандартного раствора, приготовленного на цементах различного состава на различных заводах.
Оценка влияния других, несиликатных, клинкерных минералов на прочность весьма затруднительна. Согласно Ли, возможные несоответствия объясняются присутствием стекла в клинкере. Другими словами, наблюдаемые отклонения объясняются статистической природой явлений, в которых мы игнорируем влияние некоторых переменных. К тому же есть некоторые признаки, что аддитивность не может быть здесь достаточно полной.
Пауэре обнаружил, что некоторые продукты образуются на всех стадиях гидратации цементного камня; это следует из того, что для данного цемента поверхность гидратированного цемента пропорциональна количеству связанной воды независимо от В/Ц и возраста. Таким образом, степени гидратации каждого компонента в данном цементе одинаковы — это довольно неожиданный вывод, отличающийся от описанных ранее результатов испытаний по определению степени гидратации различных клинкерных минералов.
Если природа продуктов гидратации одинакова в любом возрасте, то тепловыделение на единицу веса гидратированного вещества должно быть постоянным в любом возрасте (рис. 1.14). Это положение выявлено Фербеком и Фостером. Хотя гипотеза о равных частичных скоростях гидратации еще противоречива, в настоящее время полагают, что в пределах лимитированного диапазона составов обычного и быстротверде-ющего портландцементов эта гипотеза в основном может быть использована. Однако поведение других цементов с более высоким содержанием C2S, чем обычные или быстротвердеющие цементы, не соответствует этой гипотезе. Экспериментальное определение теплоты гидратации показывает, что C3S гидратируется раньше, а некоторое количество C2S начинает гидратироваться позже.
Первоначальный каркас цементного камня, возникший во время схватывания, влияет в значительной степени на дальнейшую структуру продуктов гидратации, в особенности на трещиностойкость и интенсивность роста прочности. Следовательно, не удивительно, что существует определенная зависимость между степенью гидратации и прочностью. На рис. 1.15 показана эмпирическая зависимость между прочностью бетона при сжатии и содержанием связанной воды в цементном камне при В/Ц = 0,25. Эти данные согласуются с наблюдениями Пауэрса за отношением гель: пространство, согласно которым повышение прочности цементного камня есть функция увеличения относительного объема геля независимо от возраста, В/Ц или минералогического состава цемента. Однако общая величина поверхности твердой фазы связана с минералогическим составом цемента, который влияет на фактическую величину конечной прочности.
Влияние второстепенных составляющих на прочность цементного камня пока недостаточно исследовано, так как считали, что эти составляющие не имеют важного значения для прочности бетона. Предполагают, что КгО замещает одну молекулу СаО в C2S с соответствующим повышением содержания C3S против расчетного.
Последние данные по изучению влияния щелочей на прочность показали, что рост прочности в возрасте свыше 28 суток зависит от содержания щелочей: чем больше щелочей содержится в цементе, тем меньше прирост прочности. Данных о влиянии щелочей на интенсивность роста прочности цемента в возрасте до 28 суток нет.
Известно, что щелочи взаимодействуют с так называемыми реакционноспособными заполнителями; в этих условиях ограничивают содержание щелочей в цементе до 0,6% (в расчете на Na2O). Такие цементы иногда называют низкощелочными цементами.
Можно видеть, что щелочи — немаловажный компонент цемента, однако данные об их роли недостаточно полны.